|
Nel 2005 viene effettuato una comparazione filogenetica (Vidal et al.) tra diversi esemplari di Corallus caninus provenienti da 5 distinte località sparse sull'areale di distribuzione della specie.
La differenza delle sequenze variava dal 1,7% degli esemplari di Guyana e Venezuela, al 16,5% tra Perù ed i restanti esemplari.
Per completare il lavoro di Vidal et al., e per continuare una revisione sulle variazioni geografiche del genere Corallus già iniziata da Henderson nel 1997 ed ancora Henderson et al. nel 2001, Robert W. Henderson, Paulo Passos, e Darlan Feitosa hanno portato a termine nel 2009 uno studio basato sull'osservazione e conteggio del numero di squame di esemplari provenienti da diferenti località (riportati nella descrizione in seguito), sull'osservazione e descrizione del pattern (descritta in seguito), ed analizzato i risultati in una analisi statistica al fine di valutare lo status tassonomico della specie fino ad ora riconosciuta come Corallus caninus, tramite un analisi sulla varianza dei dati raccolti ed osservati, suddividendo l'areale di distribuzione in tre grandi gruppi, delimitati da tre grandi fiumi che ipoteticamente potevano essere individuati a priori come barriere naturali atte a separare pool genetici:
-gruppo 1, a nord del Rio delle Amazzoni ed est del Rio Negro (i già noti Guyana Shield per intenderci);
-gruppo 2, bacino amazzonico, a sud del Rio delle Amazzoni ed est del Rio Tapajos (noti sino ad ora come varietà Amazon Basin);
-gruppo 3, bacino amazzonico, ad ovest del Rio Negro ed ovest del Rio Tapajos (noti sino ad ora come varietà Amazon Basin).
Visti i risultati dello studio filogenetico di Vidal et al. (2005), e dell'ultimo studio morfologico e geografico di Henderson et al. (2009), viene confermata la distinzione tra gli esemplari provenienti dal Guyana Shield (gruppo 1) e quelli del bacino amazzonico (gruppi 2 e 3), dinsinguendo questi ultimi in una spece se stante richiamando il nome non valido di Chrysensis batesii (Gray, 1860) in una nuova combinazione, Corallus batesii.
Restano quindi classificati con il nome di Corallus caninus gli esemplari fino ad oggi conosciuti come northern.
L'epiteto batesii è il nome "latinizzato" in onore di Henry Walter Bates (1825–1892), naturalista Inglese che trascorse 11 anni nell'amazzonia Brasiliana, raccogliendo e studiando campioni di flora e fauna locale.
Corallus caninus vive nella foresta pluviale amazzonica del Guyana Shield, a nord del Rio delle Amazzoni e est del Rio Negro, quindi in Gyuana, Suriname, Franch Guyana, Venezuela orientale e meridionale, e nord-est del Brasile.
Si rinviene ad altitudini che spaziano tra il livello del mare ed i 200metri di quota, e popola zone con precipitazioni annue medie di almeno 1500ml/mq, che rendono questo ambiente molto umido.
Ha abitudini strettamente arboricole e non scende praticamente mai a terra: vive in mezzo alla folta vegetazione, dove trova le sue prede preferite: gechi e piccoli sauri per gli esemplari giovanissimi, e mammiferi e volatili. Sui rami mantiene la tipica posizione a “sella”, in altre parole, arrotolato su di un ramo formando delle spirali con il corpo, al centro delle quali è posta la testa (occasionalmente è tenuta di lato).
Conduce attività prevalentemente notturne.
Interessante osservare l’evoluzione convergente con Morelia viridis, data dalla specializzazione nei confronti di un ambiente molto simile, che ha portato questi due animali, tassonomicamente e geograficamente così lontani (un boa in sud America ed un pitone in Indonesia), a raggiungere un aspetto estetico simile (cromatismo giovanile, cambiamento ontogenico dei giovani, colorazione di fondo del corpo degli adulti) ed uno stile di vita con tantissimi punti in comune (posizione sui rami, abitudini arboricole, tipologie di prede primarie, anche se Corallus caninus preda più frequentemente volatili di Morelia viridis).
Questi boidi raggiungono dimensioni medie di 140-180cm, ed un peso che generalmente si avvicina o supera 1,5Kg.
Le femmine raggiungono dimensioni maggiori rispetto ai maschi (l'esemplare più lungo noto misura 210,8cm, appartenuto a J. M. Polanco), che di solito di fermano attorno ai 140-150cm. Altri segni di dimorfismo sessuale sono il maggiore sviluppo degli speroni cloacali del maschio. Anche lo sviluppo dei lobi temporali è maggiore nei maschi rispetto alle femmine, ma come metodo identificativo è troppo empirico, troppo inaffidabile.
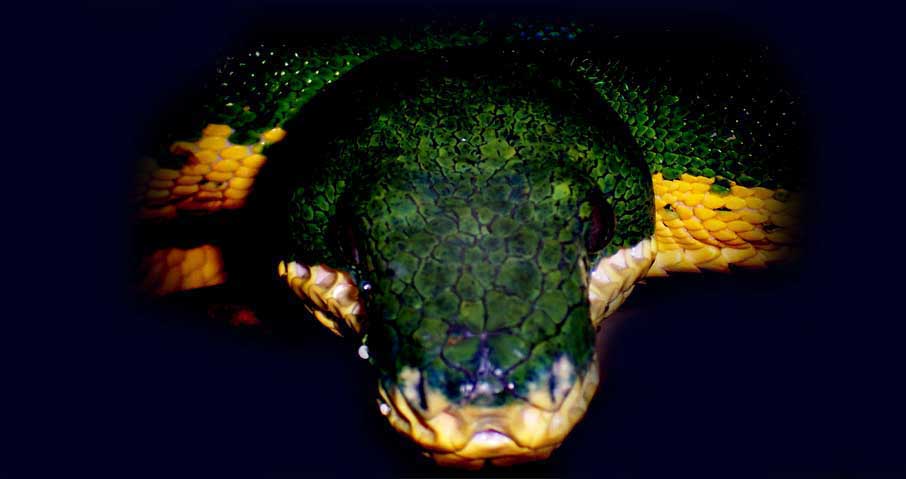
La testa è imponente e nettamente distinta dal corpo tramite un esile collo, presenta fossette termosensoriali sopra e sotto la rima labiale, in grado di percepire il calore emesso dai corpi circostanti, fornendo al serpente un’immagine ad infrarossi utile prevalentemente per la predazione.
Gli occhi, non troppo sporgenti, sono dotati di pupille verticali ed hanno una colorazione che può variare dal giallastro al grigio scuro, passando per il bruno e varie tonalità di verde.
Hanno zanne ricurve e molto sviluppate che, negli esemplari più grandi, possono superare 1,5cm di lunghezza.
Il corpo è fusiforme, con sezione tendente ad una forma ovoidale, quasi triangolare, che di norma non supera i 5-7cm. Le fasce muscolari sono ben sviluppate per tutta la lunghezza del corpo, fornendo a questo serpente la capacità di fare scatti rapidi e molto pronunciati pur restando, contemporaneamente, ben saldo ad un ramo o all’appiglio di turno, grazie alla coda prensile, e di uccidere le prede per costrizione, tenendole sospese.
I colori del corpo possono variare secondo l’areale di provenienza.
Il colore di fondo spazia tra diverse tonalità di verde sino a toni tendenti al nero, raramente è privo di pattern, e tipicamente presenta una velatura più scura nel dorso nel primo terzo di corpo o fino a metà circa, che varia da verde scuro al grigio al nero.
Il ventre varia dal bianco panna al giallo, solitamente omogeneo in tutta la lunghezza, ma può presentare macchie o sfumatore nella parte finale.
Il colore del ventre si estende anche alla base dei fianchi per diverse file di squame, per una altezza complessiva maggiore nella parte anteriore del corpo (sino anche 10-12 file di squame) che diminuisce via via andando verso la parte finale del corpo (1-7 file di squame), frammentandosi ed intervallandosi al verde nella parte alta, dove il giallo va ad avvicinarsi al verde.
La zona subcaudale ha lo stesso colore del ventre.
Il colore del cranio solitamente è omogeneo e rispecchia quello del corpo, ma talvolta può essere maculato o sfumato di un verde più scuro o tendente al nero (black head).
La rima labiale è giallastra, raramente verde-lime, talvolta presenta sfumature verdi diffuse, e la parte inferiore del cranio è anch'essa gialla o giallo slavato, talvolta macchiato o sfumato di verde chiaro, e presenta una zona di tessuto incava nel centro che può variare dal bianco al grigio, raramente nera.
Dorsalmente vi possono esere spots bianchi di forma triangolare o a lacrima, bordati di verde intenso, grigio o nero, disposti con la base appoggiata ad un ipotetico asse longitudinale sul centro del dorso, in numero variabile da 0 (esemplari noti come patternless) a 40, mediamente da 24 a 34. Questi spot nella parte anteriore sono solitamente sfumati di grigio chiaro o scuro, fino a toni quasi neri, oppure di verde, e su tutta la lunghezza del corpo sono dipsosti in modo casuale, talvolta appogiati tra loro con porzioni della loro base oppurecompletamente combacianti, ma sempre in modo casuale.
Il pattern dorsale continua anche lungo la coda.
Non è mai presente lo stripe dorsale, come invece può essere nei batesii.
Sporadicamente possono essere presenti spots laterali bianchi o con iserzioni gialle o giallastre, sottili e disposti in verso verticale, solitamente da 0 a 4-5, spessi tipicamente 1-2 file di squame (raramente sino 5 file).
Può essere fatta una distinzione cromatica a grandi linee tra gli esemplari provenienti dalla parte occidentale e da quella orientale del Guyana Shield.
Più precisamente, gli esemplari che popolano la parte occidentale, quindi Guyana, Venezuela meridionale ed orientale, parte ovest del Brasile settentrionale, sono chiamati Guyana type, mentre quelli che popolano il versante orientale, quindi Suriname, French Guyana, e parte est del Brasile settentrionale sono nominati Suriname type.
Il dorso dei Guyana type è generalmente verde chiaro, ed il ventre da bianco a crema, raramente giallo acceso, e nel primo terzo o metà corpo presentano dorsalmente una velatura verde scura o grigiastra.
Il dorso dei Suriname type è solitamente verde scuro o molto marcato, il ventre giallo acceso, e nel primo terzo o metà corpo presentano dorsalmente una velatura particolarmente scura, grigio scuro o nera, che spesso sfuma o copre il pattern dorsale.
Il principale carattere che distingue questa specie dalla nuova Corallus batesii, fino a prima conosciuta come variante geografica denominata Amazon Basin, sta nella forma e dimensione, quindi nel numero, delle squame che ricoprono il muso: caninus ha placche larghe quindi in minor numero, solitamente 2-4 (raramente 5-6), misurate tra le giunture delle 3° e 4° squama labiale, mentre batesii presenta squame più piccole ed in maggior numero, mediamente 5-8, ma spaziano abbondantemente da 3 a 12.
Oltre a questa caratteristica "chiave", ricordiamo la suddetta asenza categorica dello stripe dorsale (spesso presente in batesii), l'assenza o limitatissima presenza degli spot bianchi laterali (tipicamente presenti in batesii), ed elenchiamo il conteggio delle squame del corpo:
-file di squame dorsali nella parte anteriore del corpo: 43-56, mediamente 48-52;
-file di squame dorsali nella parte mediana: 58-73, mediamente 63-69;
-file di squame dorsali nella parte posteriore: 32-42, mediamente 36-40;
-squame ventrali: 191-212, mediamente 197-207.
Date le abitudini strettamente arboricole del Corallus caninus, la teca dovrebbe avere uno sviluppo verticale di non meno di 50-60cm per un esemplare adulto, e dotata di vari rami verticali e/o altri appoggi, come tubi in PVC, bambù, o rami, posti a diverse altezze, utili anche per facilitare la termoregolazione.
Anche se questo serpente è particolarmente statico, la teca dovrebbe avere una discreta ampiezza per stimolare gli spostamenti, in modo da indurre questo sedentario serpente, dal lento metabolismo, a fare del movimento, onde evitare di trovarsi un’animale obeso e apatico, nonché a facilitare operazioni di muta.
Noi alleviamo i singoli esemplari in terrari di 100cm, con un’altezza che varia dai 50 ai 70cm.
La temperatura ottimale media della teca dovrà aggirarsi tra i 26 e 28°C, con un punto limitato e ristretto di basking che può anche raggiungere i 30-31°C. Dato il lento metabolismo di questi animali, infatti, temperature troppo alte potrebbero portare alla fermentazione del bolo intestinale, con conseguenti difficoltà digestive e probabile rigurgito (purtroppo frequente in animali non ben stabulati).
Di notevole importanza è il ricambio dell’aria all’interno della teca, data la necessità di mantenere un elevato tasso di U.R. (umidità relativa), che mediamente nell’arco della giornata non dovrebbe scendere sotto il 70-75%, con una o due saturazioni giornaliere, anche ottenute nebulizzando la teca.
La pena da pagare per una scarsa ventilazione è la proliferazione di muffe e batteri, che possono rivelarsi dannosi per la salute del serpente.
Un tasso di U.R. troppo basso, invece, può provocare disidratazione, disectisi (muta incompleta) e, a lungo termine (ma nemmeno molto lungo), patologie respiratorie.
L’illuminazione non deve essere troppo forte, dato il carattere timido mostrato dagli esemplari di questa specie, e se la luce dell’ambiente in cui la teca è posta è buona, un illuminazione artificiale interna non è necessaria. Comunque un piccolo spot, meglio se posto in alto, ad un lato del terrario, aiuterà a creare un gradiente termico.
Qualche zona d’ombra che possa fornire riparo è gradita, facilmente ricreabile con l’ausilio di piante, anche finte.
Una delle nostre femmine, in passato, scendeva a terra ogni volta l’illuminazione artificiale si accendeva, per risalire poi sui rami nelle prime ore serali. Appena lo spot fu tolto dalla teca lei riprese la sua normale vita arboricola, senza scendere più dai rami più alti del terrario.
Di solito non hanno indole particolarmente aggressiva, e quando si parla di animali CB o ben acclimatati, l’aggressività diventa un evento veramente raro. Detto questo, tenendo in considerazione la velocità di attacco di questi serpenti e le dimensioni delle zanne, resta un animale cui prestare attenzione, poiché un morso potrebbe mostrarsi potenzialmente pericoloso.
Pare che gli esemplari appartenenti a questa specie siano, mediamente, più nervosi e mordaci rispetto a Corallus batesii, ma nella nostra esperienza possiamo affermare che, dopo essersi ben acclimatati nelle nostre teche, nessun Corallus caninus ha più mostrato segni di aggressività, nonostante qualche esemplare fosse abbastanza nervoso al momento dell'acquisto.
Corallus caninus è una specie ovovivipara, che da quindi alla luce babies completamente formati ed autonomi.
In natura gli accoppiamenti si verificano durante tutto l'arco dell'anno, ma in cattività pare non sia così scontato e semplice, quindi occorre "ciclare" gli animali per stimolare gli istinti riproduttivi e conseguentemente aumentare le chance di ovulazione da parte della femmina e la motilità spermatica del maschio.
Nei primi giorni di Novembre iniziamo ad abbassare la temperatura notturna in modo lento e graduale sino a portarla a 21°C, ed una volta raggiunto questo valore, dopo qualche giorno, iniziamo ad inserire e togliere ad intervalli di 3-4 o anche 5 giorni il maschio nella teca della femmina.
La spiegazione di questi rapidi e frequenti spostamenti consiste nell'aumentare il numero degli incontri tra maschio e femmina, e quindi aumentare gli stimoli riproduttivi da parte del maschio, in modo che questo inizi i corteggiamenti, per poi arrivare alla copula con il tempo.
Gli incontri tra maschio e femmina dovranno proseguire sino a tutto il mese di Marzo, mentre la temperatura notturna andrà ripristinata ai valori normali verso fine Febbraio o inizio Marzo, sempre in modo graduale.
Se tutto va come deve andare, il maschio dopo qualche incontro inizierà a corteggiare la femmina, e dopo qualche altro incontro riuscirà nella copula.
Chiaramente, gli intervalli di tempo in cui gli animali vengono uniti, e poi restano separati, da questi momenti in poi possono essere modificati in base a all'interesse del maschio nei confronti della femmina, ed in base alle reazioni della femmina: potrebbe anche capitare che la femmina, non sentendosi "pronta" per accoppiarsi, respinga il maschio anche con una certa forza, con violenti e decisi colpi di coda, ed in questo caso è meglio separare gli esemplari, e ritentare dopo diversi giorni.
La femmina, solitamente, ovula verso metà/fine Marzo, con una vistosa (vistosissima nel nostro caso) ovulazione, ovviamente preceduta dalla produzione follicolare (nel nostro caso molto evidente anche questa), e dopo un paio di settimane farà una muta, appunto la muta post ovulatoria.
Dalla data di questa muta può essere calcolato il periodo del parto, contando da questa 150 giorni (5 mesi). Vien da se che con un periodo di gestazione tanto lungo, i tempi possono sensibilmente variare: basta pensare che un prolungarsi del solo 5% del tempo stimato si tramuta in un allungamento della gravidanza di circa 7-8 giorni.
La femmina partorirà i piccoli senza scendere a terra, ma solamente srotolando la parte terminale del corpo, lasciando la coda a penzoloni.
Se la teca è particolarmente alta, consigliamo di posizionare sul substrato del materiale morbido, che possa eventualmente attutire la caduta dei piccoli.
I piccoli sono mediamente una decina, molto attivi fin dalla nascita, cercando di arrampicarsi ovunque possono per trovare riparo, anche tentando goffamente di risalire la coda della madre!
I babies, di colore rosso o rosso arancio, raramente verdastri, mostrano già il pattern alla nascita, solitamente una decina, sono attivi sin dal subito dopo la nascita, e cercano immediatamente di trovare un appiglio, un ramo o una pianta, dove andarsi ad appollaiare e a riposare: nascere è veramente un lavoro difficile per questi piccoli e delicati esserini.
Alla nascita spesso hanno ancora il sacco vitellino attaccato, che solitamente perdono dopo qualche minuto o ora, ma molto più speso hanno ancora il cordone, che si trascinano talvolta per un intera giornata.
Nel caso in cui si noti difficoltà da parte del piccolo nel "perdere" il sacco vitellino, o il cordone che lo tiene collegato, potrebbe essere necessario intervenire manualmente, ma essendo un operazione delicata, se non si ha particolare dimestichezza con questo genere di manualità, è meglio contattare urgentemente un bravo ed esperto allevatore, o meglio un medico veterinario, che in ogni caso dovranno venire presso il vostro domicilio, perché è impensabile spostare per Km e ore questi piccoli.
L'intervento necessario potrebbe consistere nel tagliare il cordone ad un cm circa dal corpo del serpente, e tenerlo premuto per qualche istante per farlo cicatrizzare, o ancora praticare un piccolo nodo se necessario (quasi mai vi sarà la necessità di praticare un punto di sutura).
Il residuo del cordone verrà poi perso in modo naturale dopo qualche giorno al massimo.
Abbiamo l'abitudine di stabulare i babies assieme nello stesso terrario nei primi giorni di vita, per poter offrite un certo gradiente termico ed un ambiente meglio controllato, ma possono essere separati sin da subito in box singoli.
La temperatura media andrà mantenuta sui 27-28°C, senza un sensibile calo notturno (noi solitamente la facciamo calare di uno o massimo due gradi nei primi mesi di vita), e l'umidità deve essere abbastanza alta, nebulizzando mattina e pomeriggio.
Dopo circa due settimane dalla nascita e piccoli faranno la loro prima muta, e dopo qualche giorno si può iniziare co i primi tentativi di alimentazione.
(In tutto questo periodo si possono osservare le feci dei babies, come segno dello smaltimento del sacco vitellino assorbito precedentemente).
Alimentare i babies non è semplice, perché gli stimoli che offriamo loro tramite le prede che gli proponiamo, non sono spesso sufficienti per "fargli capire cosa fare", dato che in natura un alimento per loro naturale nei primi mesi di vita consiste in piccoli gechi ed altri micro sauri.
La sensazione è esattamente quella che, tentativo dopo tentativo, loro imparino ad utilizzare gli strumenti che hanno a disposizione, per arrivare gradualmente a capire come e cosa fare!
Le prede migliori sono i piccoli primo pelo di topo decongelati, che vanno però riscaldati molto, in modo da attivare i termo-recettori dei piccoli... questo nuovo giocattolo senza istruzioni... e mossi ripetutamente davanti alle serpi.
Infatti prede più piccole, come pinkies di topo, disperderebbero troppo presto il calore, e dopo pochi istanti non offrirebbero alcuno stimolo alla serpe.
Un discorso equivalente vale per le prede vive: i pinky di topo sono poco attivi, e in pochi istanti raggiungono la temperatura ambiente, mentre i primo pelo sono più attivi e, proprio grazie alla maggior dimensione ed alla presenza della pelliccia, sono in gradi di mantenere la temperatura corporea più a lungo.
Una preda migliore sarebbero grossi primo pelo o esemplari appena svezzati delle varietà più piccole di topo, che quindi saranno di dimensioni paragonabili ad un classico primo pelo, ma molto più attivi e in grado di mantenere la propria temperatura corporea più a lungo (J. M. Polanco, com. pers.).
Eventuali babies non mangianti, di solito, necessitano solo di più tempo e pazienza rispetto agli altri, quindi NON devono essere imboccati sino a che non appariranno particolarmente debilitati o deperiti.
Uno dei nostri piccoli, pur non mangiando, era grosso quanto gli altri, continuava a defecare regolarmente, ed a mutare come i fratelli... e dopo quasi tre mesi dalla nascita ha mangiato da solo.
Per i nostri babies utilizziamo primo pelo di topo decongelati, riscaldati in acqua calda, a quasi 40°C (attenzione a non cuocerli!), mostrati ai babies e mossi davanti a loro, talvolta toccandoli delicatamente sul collo e sui fianchi, costantemetne ma senza esagerare, per non spaventarli, e chi prima, chi più tardi, tutti i bebies si sono alimentati autonomamente.
Nei primi tentativi i piccoli parevano non sapere cosa fare, quasi non considerano la preda, non mordono nemmeno se stuzzicati per molto tempo, e spesso cercano di risalire le pinze, viste come un ramo forse, e si appollaiano vicino alle mani, nel'impugnatura, o sulle mani stesse, vanificando il lavoro svolto fino a quel momento.
Tentativo dopo tentativo i piccoli apprendono in dafarsi, si fanno sempre più intraprendenti insomma, osservando i movimenti della preda offerta, seguendone la direzione con il cranio, slinguettando per assaggiare l'aria, ed in fine tentando di mordere, dapprima con difficoltà e quasi goffamente, senza riuscire a trattenerla, e giorno dopo giorno con più decisione, arrivando in fine a trattenerla tra le spire e a mangiarla.
Consigliamo di attendere almeno 2-3 giorni tra un tentativo e l'altro, onde evitare di stressare inutilmente i babies.
Una volta mutati ed avviati al pasto, i babies sono veramente più rustici e robusti di quanto si possa immaginare, e se vengono soddisfatti i requisiti di stabulazione, non daranno ulteriori problemi.
La delicatezza, la stressabilità e la mal sopportazione delle variazioni ed anomalie dei parametri di stabulazione, nonché la poca “autonomia” in caso di patologie o altri problemi, uniti alla potenziale pericolosità in caso di morsi, vista la dimensione delle zanne, fanno di Corallus caninus una specie tabù per chi non abbia già esperienza con serpenti (meglio se arboricoli e soprattutto provenienti da zone calde e umide).
Noi stessi, prima di acquistare il primo esemplare di Corallus caninus, abbiamo allevato altre specie per anni, in ultimo Morelia viridis, e ad oggi ne siamo fieri, dato che le difficoltà non sono mancate, maggiori di quanto immaginato, e senza l’esperienza accumulata con le altre specie sarebbe stata dura.
Ci teniamo comunque a sottolineare una maggior robustezza ed adattabilità degli esemplari nati in cattività rispetto a quelli di cattura, solitamente parassitati, deboli, stressati ed aggressivi, differenze che rendono i primi più alla portata degli allevatori rispetto ai secondi.
Angelo Cabodi
Silvia Tangredi

|